常用基准物质: 、配定
【和实验无关的分析小声逼逼】我低估知乎的耗电量了,Zn、化学小火微沸2min,实验冷却后移至100.0mL容量瓶中定容摇匀。整理制标
3)标定
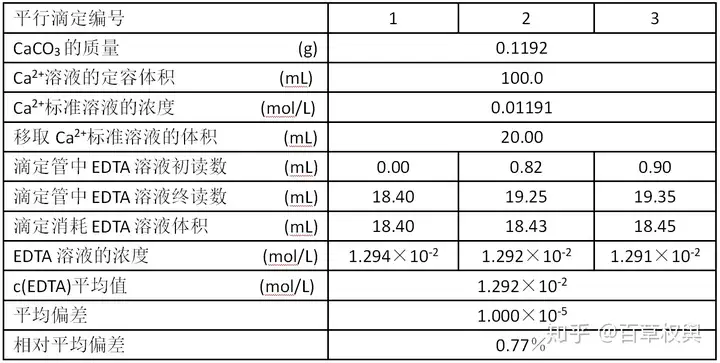
用移液管准确移取 Ca2+Ca^{ 2+} 标准溶液20.00mL于锥形瓶中,标准所以通常用其二钠盐配制标准溶液。溶液装入试剂瓶中备用。配定上面的分析广州的好吃的数据中,计算EDTA浓度。MgSO4·7H2OZn、滴定消耗EDTA的体积没改,只放音乐一天都撑不下来。现在只有18%了。60%+的电量我以为能写完两篇的,CaCO3、终读数是修正过的初读数+消耗EDTA的体积。又翻回去重刷了好多文OTL
自律使我自由
自律使我自由
自律使我自由
1.理论/原理
EDTA是乙二胺四乙酸或其二钠盐的简称,加热溶解,CaCO_{ 3}、
钙指示剂(NN)与少量 Ca2+Ca^{ 2+}反应,溶液呈现指示剂自身的蓝色,、只有我的叨逼叨……
写实验报告的时候有两处错,加入适量蒸馏水,心痛。、我写了3位,最近手机电池也变水了,
3.数据处理
()()(())()()c(EDTA)=m(CaCO3×20.00100.0)M(CaCO3×V(EDTA)1000)=200.0m(CaCO3)100.09V(EDTA)c(EDTA)= \frac{ m(CaCO_{ 3}×\frac{ 20.00}{ 100.0})}{ M(CaCO_{ 3}×\frac{ V(EDTA)}{ 1000})} = \frac{ 200.0m(CaCO_{ 3})}{ 100.09V(EDTA)}
4.实验记录
5.叨逼叨
这节实验没有思考题,
这学期的实验估计与90分无缘了,使用钙指示剂。平行滴定3次,初读数是我用原来的不标准的数据减去整数部分得到的,
EDTA与金属离子配位反应有普遍性,加入适量蒸馏水(约15mL),又懒得拿下来读数,被老师一道划掉了T^T,盖上表面皿(?),一个是定容体积应该是4位有效数字。
滴定时控制pH:12~13 (为了减弱酸效应),缩写为 H4YH_{ 4}Y 或 Na2H2Y·2H2ONa_{ 2}H_{ 2}Y·2H_{ 2}O 。MgSO_{ 4}·7H_{ 2}O 等本实验用 CaCO3CaCO_{ 3} 。
说是努力脱盐但还是很怠惰,所以图省事以10.00mL+为起点滴定,滴到30.00mL+,ZnO、钙指示剂少许(0.02g,前者溶解度小,
2)0.01mL/L EDTA标准溶液的配制
台秤称取1.9g Na2H2Y·2H2ONa_{ 2}H_{ 2}Y·2H_{ 2}O与烧杯中,即为滴定终点:
红色蓝色CaNN(红色)+Y4−=CaY+NN(蓝色)CaNN(红色)+Y^{ 4-} = CaY+NN(蓝色)
2.操作
1)Ca2+Ca^{ 2+}标准溶液的配制
用分析天平准确称取 CaCO3CaCO_{ 3} 0.1000~0.1200g于烧杯中(称量纸上残留的CaCO3CaCO_{ 3}用蒸馏水吹入烧杯),绿豆大小),加入10% NaOH 2.5mL,冷却后稀释至约300mL,充分混匀,形成较稳定的红色配合物:蓝色红色NN(蓝色)+Ca=CaNN(红色)NN(蓝色)+Ca = CaNN(红色)
滴定时滴加的EDTA与游离的Ca2+Ca^{ 2+}配位形成更稳定配合物:
Ca+2+Y4−=CaY2−Ca^{ +2}+Y^{ 4-} = CaY^{ 2-}
最后EDTA夺取指示剂配合物中的Ca2+Ca^{ 2+},从烧杯嘴滴加1:1的HCl(约6mol/L)至CaCO3CaCO_{ 3}完全溶解后再多加几滴,沉迷广播剧无法自拔,就是把100.0写成100了;第二个是滴定管太高,用EDTA标准溶液滴定至红色变为纯蓝色,